Implementación de los requisitos UDI con tecnología modular y flexible
Anualmente, las falsificaciones y la desviación de productos y dispositivos sanitarios a otros mercados ocasionan pérdidas de miles de millones de euros. En este contexto, la implementación de los requisitos UDI a nivel internacional es una medida muy necesaria para reducir las consecuencias del fraude y mejorar el flujo de datos y la transparencia entre todos los agentes internacionales.
A pesar de los retos diarios a los que ya se enfrentan los fabricantes de productos sanitarios (grandes inversiones para cumplir con la normativa vigente, complejidad organizativa,…), el sistema de Identificación Única de Dispositivos y la mejor trazabilidad de productos sanitarios sin duda serán muy beneficiosos a largo plazo ya que ayudarán a frenar las falsificaciones, prevenir las importaciones paralelas y potenciar el control de datos y la transparencia en el sector.
Libro blanco – Cumplimiento Normativo: Un Repaso Global a la Identificación Única de Dispositivos
Rápido acceso a la información de los productos, protección reforzada contra las falsificaciones y el mercado gris,… La Identificación Única de Dispositivos (UDI) para productos sanitarios está llamada a revolucionar la industria de los productos sanitarios. Al mismo tiempo, plantea numerosas cuestiones y despierta la preocupación de las empresas fabricantes y etiquetadoras. Es importante considerar la situación desde una perspectiva global y estar al tanto en todo momento de las novedades y reformas relacionadas con la normativa UDI.
Descubra más sobre los desafíos de la implementación UDI y las claves del éxito desde una perspectiva global en este Libro Blanco, un documento que ofrece una visión general de las últimas novedades en el ámbito internacional para los fabricantes y etiquetadores de productos. Sin duda es una valiosa fuente de información para las empresas que fabrican y etiquetan productos en distintos mercados.
Los Principios básicos del sistema de Identificación Única de Dispositivos en la UE
Con el objetivo de cumplir con los requisitos UDI y sus fechas de aplicación, las empresas de productos sanitarios deben pasar por la fase de implementación, que incluye la actualización de las líneas de embalaje con nueva tecnología y la integración de soluciones IT adicionales. Siguiendo los Reglamentos de la Unión Europea EU MDR e IVD (Reglamentos sobre Productos Sanitarios y sobre Productos Sanitarios de Diagnóstico In Vitro), los fabricantes de productos sanitarios serán plenamente responsables del cumplimiento de los siguientes pasos:
Asignación de UDI a productos individuales
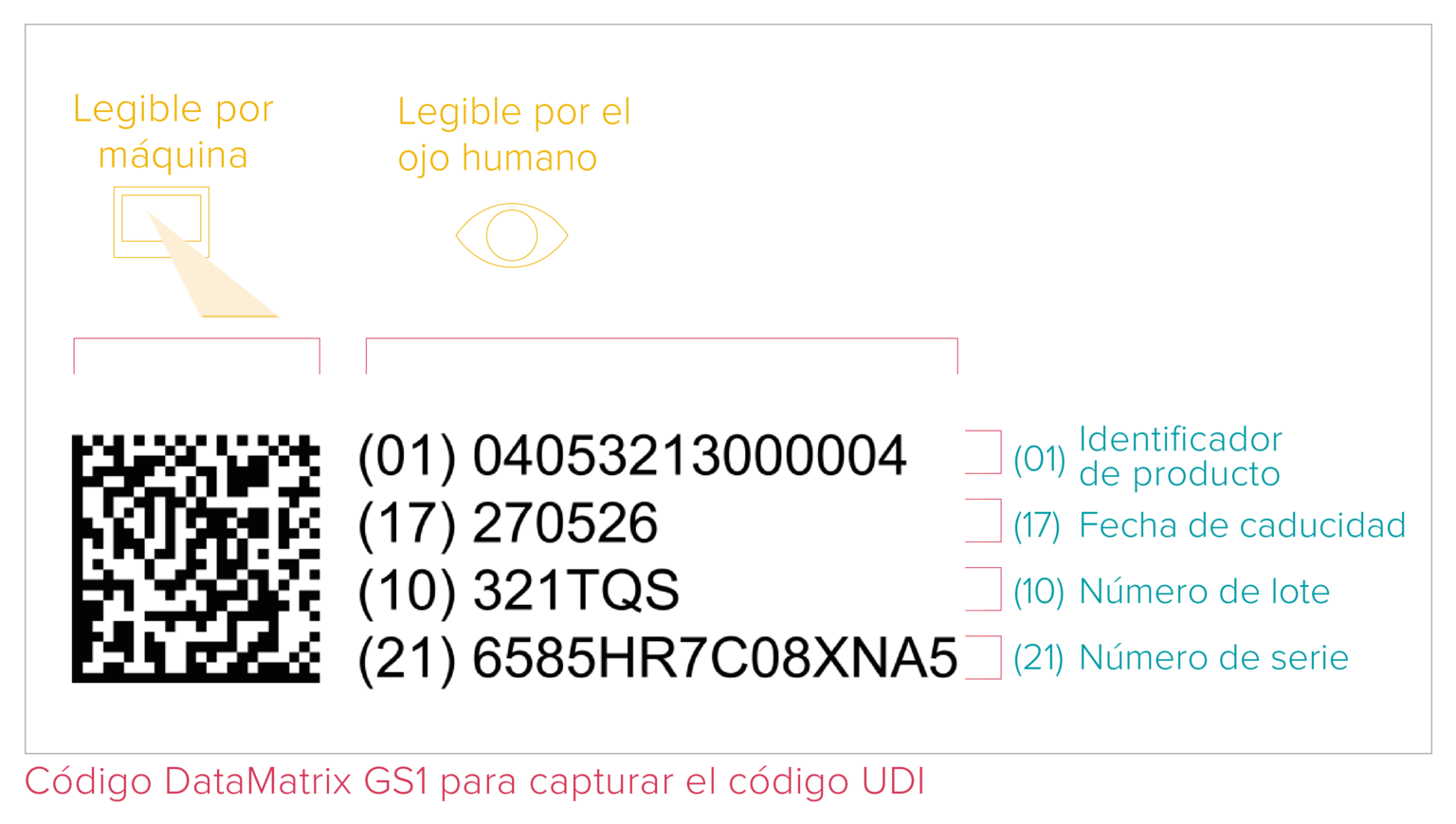
Con muy pocas excepciones, todos los productos sanitarios comercializados en el mercado deben tener asignado un Identificador Único de Dispositivo que incluya los siguientes datos:
- Un Identificador de Dispositivo (UDI-DI) con información fija sobre el fabricante y el producto;
- Un Identificador de Producción (UDI-PI) con datos variables sobre la producción, como el número de serie o lote, la fecha de fabricación y la fecha de caducidad.
Sin embargo, los requisitos UDI no obligan a los productores a generar datos UDI-DI. Estos datos los recibirán directamente de una de las agencias emisoras autorizadas –GS1, HIBCC, ICCBBA o IFA– que pueden elegir libremente.
Colocación del código UDI en un producto y su embalaje
El código UDI es un código de lectura mecánica (ICAD) y humana (HRI). El sistema ICAD se refiere a la Identificación y Captura Automática de Datos (o AIDC, por sus siglas en inglés para Automated Identification for Data Capture) y puede ser un código de barras lineal o una DataMatrix, etc. Según se recoge en los requisitos UDI, el código UDI debe constar directamente en el producto en caso de tratarse de un producto reutilizable, o estar situado en su etiqueta y en los demás niveles superiores de embalaje.
La calidad de impresión del código de barras depende de varios factores diferentes relacionados con la calidad y las condiciones de almacenamiento de los materiales de embalaje. Aunque no existen requisitos de verificación del código de barras UDI específicos, GS1 exige su conformidad con los estándares de verificación ISO/IEC para garantizar la legibilidad del código de barras por parte de todos los agentes que participan en la cadena de suministro.
Registro y actualización de datos UDI en EUDAMED
EUDAMED, una base de datos europea interoperable creada para recoger, actualizar e intercambiar información sobre los productos sanitarios, servirá como punto de acceso para los entes regulatorios, operadores económicos, proveedores sanitarios y público en general.
Adhesión al calendario de conformidad UDI
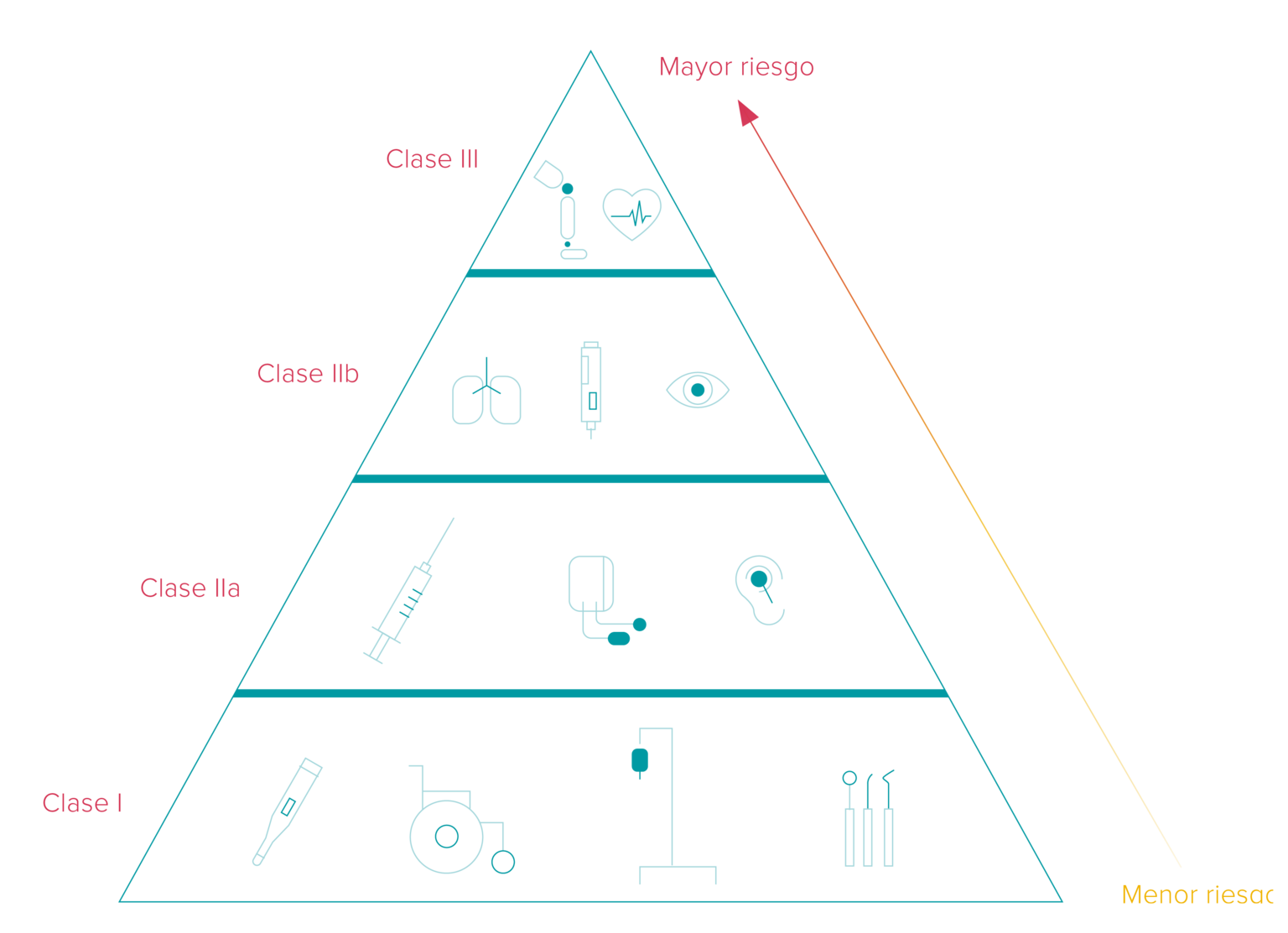
Los plazos para la implementación UDI varían dependiendo de la clasificación de los dispositivos de diagnóstico médico e in vitro en tres categorías diferentes que remiten a sus correspondientes niveles de riesgo. Además, el marco temporal depende de si el productor coloca el código UDI en el propio producto o en su etiqueta.
¿Quiere saber más sobre los requisitos UDI para fabricantes de productos sanitarios?
Requisitos UDI desde una perspectiva global
Para facilitar la trazabilidad de los productos sanitarios y evitar la desviación de productos y las falsificaciones, EEUU fue el primer país que introdujo un sistema UDI para los productos sanitarios distribuidos en su mercado.
Los requisitos UDI instaurados por la FDA (Agencia de Medicamentos y Alimentación estadounidense) están, principalmente, basados en las directrices del International Medical Device Regulators Forum (IMDRF) y articulados en una base de datos nacional centralizada (GUDID) que cumple la función de ser un catálogo público de referencia para todos los productos codificados con UDI.
La importancia de la identificación única de dispositivos también ha sido reconocida por otros muchos países con mercados emergentes, incluyendo a China, India, Brasil, Corea del Sur, Arabia Saudí y Taiwán, entre otros. Este desarrollo global tiene un impacto directo en el modo en que los fabricantes internacionales etiquetan sus productos y gestionan los flujos de datos UDI en diferentes lugares.
A pesar de los esfuerzos del IMDRF para ayudar a estandarizar los requisitos UDI en todo el mundo, lo cierto es que las exigencias difieren notablemente de un país a otro. Estas diferencias pueden incluir los siguientes aspectos:
- Tipos de formato de soporte UDI aceptados
- Marcaje y colocación del código UDI en el producto y su embalaje
- Requisitos de los datos UDI-DI y UDI-PI
- Fechas de aplicación para los diferentes grupos de productos
- Supuestos de actualización de los datos UDI
- Grupos de productos sujetos a los requisitos UDI en diferentes países
Estos aspectos tienen un impacto significativo en la elección de la solución de cumplimiento normativo y conformidad UDI que, teniendo en cuenta la continua actualización normativa, debe ser fácilmente adaptable y estar preparada para el futuro.
Serialización de Productos Sanitarios
Además de ser fundamental para la eficiencia del sistema de trazabilidad de productos sanitarios, la serialización es un requisito UDI para los productos implantables activos (por ejemplo: marcapasos, desfibrilador, medidor de glucosa implantable).
La serialización es un concepto que hace referencia a la asignación de un número de serie único a cada producto terminado facilitando que pueda ser identificado automáticamente en el punto de venta. La industria farmacéutica está implantando la serialización como una medida contra las falsificaciones a nivel global. En otros sectores, también esta tecnología está ganando terreno.
Incluso las empresas cuyos productos no están incluidos en la categoría de productos implantables activos se pueden beneficiar de contar en sus líneas con una tecnología flexible que garantice la conformidad UDI y la serialización. Esta medida les ayudará a mantener sus líneas de producción listas para el futuro en el caso de que la serialización se convierta en un requisito UDI imperativo para otros grupos de productos o resulte obligatorio en algunos países importadores.
Agregación de Productos Sanitarios
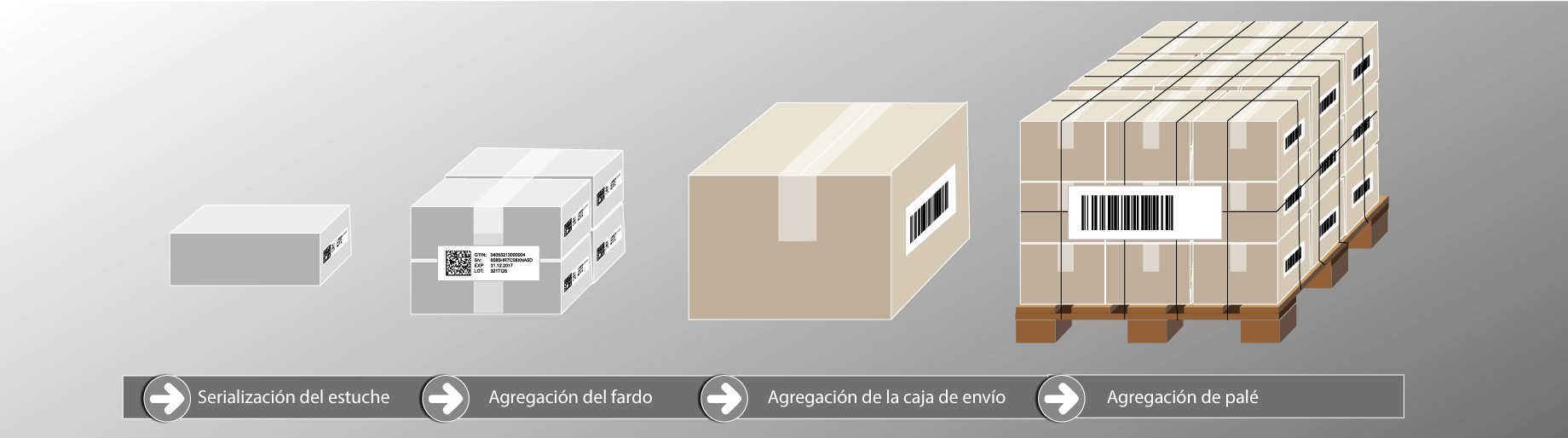
Aunque no es obligatorio según los requisitos UDI, la agregación de productos sanitarios es otro pilar para la optimización de la trazabilidad de productos sanitarios. La agregación hace referencia a la creación de una jerarquía padre-hijo entre los diferentes niveles de embalaje de los productos, comenzando por una unidad de producto hasta llegar al palé. Por ejemplo, para agregar varios productos en una caja de envío, se siguen los siguientes pasos:
- Se escanea un código de barras UDI para cada producto;
- Los datos del código de barras se agregan y enlazan con la caja de envío;
- La caja recibe su etiqueta con un código de barras UDI que incluye un número de serie único.
Este proceso se repite en todos los niveles de embalaje. Al escanear un código, el operador recibe toda la información relacionada con el UDI de los productos sanitarios que contiene la caja de envío.
Beneficios de la Agregación en las Retiradas de Productos
La agregación de productos no solo facilita la trazabilidad de los productos sanitarios, también es útil para optimizar los procesos de retirada, corrección o eliminación de productos. Si una retirada es inevitable, los fabricantes tienen la obligación de retirar la totalidad del lote de productos de la circulación en todas las ubicaciones en que se encuentren.
Como la agregación de productos sanitarios crea jerarquías padre-hijo entre los distintos niveles de embalaje, permite una retirada precisa y unitaria de los productos afectados. Esto implica que los productos pueden ser retirados o eliminados en función de su número de serie en lugar de por el número de lote. Esta nueva opción facilita un proceso de retirada mucho más directo y selectivo.
¿Tiene alguna duda sobre la agregación de productos sanitarios?
Tecnología UDI para la trazabilidad de productos sanitarios
Las soluciones TQS de Wipotec facilitan la conformidad UDI y aportan un gran valor añadido gracias a una amplia variedad de opciones extra. Dependiendo de las diferentes características de los procesos de producción y embalaje, los fabricantes pueden optar por máquinas independientes o kits OEM. Ambas soluciones cumplen de manera fiable con todos estos aspectos:
- Etiquetado o codificación conforme con normas UDI en múltiples niveles de embalaje. Tanto con máquinas independientes como con los kits OEM, el equipo TQS puede colocar un identificador único de dispositivo en las etiquetas del producto y otros materiales de embalaje. También es posible imprimir UDI en estuches plegados, antes del embalaje manual de los productos.
- Verificación y clasificación del código de barras UDI. El sistema TQS identifica y rechaza con total fiabilidad productos con códigos de barras de baja calidad para garantizar que únicamente los códigos legibles pasen el control de calidad. Además, el equipo realiza una clasificación de calidad de cada código de barras impreso coherente con los requisitos de verificación del código de barras UDI de GS1. La calidad del código de barras y la clasificación de los datos son una prueba sólida de que los códigos de barras corresponden a los estándares de calidad ISO/IEC en el punto de fabricación.
- Serialización y agregación de productos sanitarios. Las soluciones TQS son máquinas modulares multifuncionales que facilitan una trazabilidad de productos sanitarios muy fiable. Además de una fluida interoperabilidad, las máquinas pueden generar de forma autónoma números de serie, asignarlos a los productos y transferir datos al sistema.
- Etiquetado Tamper-Evident o sellado de garantía. Se coloca después de verificar la calidad del código. Es un módulo opcional disponible en las soluciones autónomas y OEM. Aunque no es un requisito UDI, el sellado de garantía asegura la integridad del embalaje.
- Interfaces abiertas e interoperabilidad. Gracias a las interfaces de comunicación abiertas, el equipo TQS puede intercambiar datos UDI con cualquier sistema en la planta de producción.
- Control de peso en línea. Es un componente opcional que permite el control de peso ultra preciso de los productos finales. Sus resultados extremadamente exactos comprueban que el embalaje final contiene todo lo que debe contener. Los productos con un peso incorrecto son rechazados. Una desviación del peso deseado normalmente implica la ausencia de algún elemento (por ejemplo, un prospecto).
Máquinas Independientes y Kits OEM
Las máquinas independientes de Wipotec son soluciones compactas, personalizables y listas para usar. Se encargan de realizar una codificación que cumpla con la normativa UDI, la serialización de productos sanitarios y la agregación y pueden ser integradas rápidamente en las líneas de embalaje. El catálogo también incluye algunas soluciones off-line para imprimir códigos UDI antes del embalaje.
Los kits TQS OEM incluyen múltiples elementos como impresoras, cámaras y etiquetadoras. Además de ser modulares y flexibles, las soluciones OEM pueden configurarse con los requisitos específicos del cliente. El equipo OEM se instala en la máquina de un tercero, por lo que es la opción preferida en centros con poco espacio. Tratándose de una solución completamente automática, la velocidad de producción que alcanza TQS OEM es realmente elevada.
Más allá de la conformidad UDI: aproveche las ventajas de las soluciones más punteras
La tecnología TQS para la conformidad UDI no solo es intuitiva y fácil de manejar, también mantiene la productividad general de las líneas de embalaje y ofrece opciones muy interesantes que aumentan la eficiencia al mismo tiempo que ayudan a los fabricantes a cumplir íntegramente con los requisitos UDI.
Funciones Inteligentes TQS:
- Gestión central de la línea para liberar al operador de la máquina, que ya no tendrá que configurar cada máquina o sus componentes por separado. Todas las opciones principales se configuran de forma centralizada en el software de gestión de la línea.
- ConfigureFast, una opción que permite la configuración y manejo más rápido e intuitivo de los componentes de codificación e inspección desde una única interfaz de usuario.
- Interfaz XML abierta para garantizar la compatibilidad con más de 80 sistemas de varios niveles (L3 + L4) para la gestión y transmisión de datos.
- TQS Traceability+ permite la recopilación de datos adicionales, como la calidad del código y el peso del producto. Estos datos pueden utilizarse de múltiples formas para reproducir la calidad de la producción.
- Servicio remoto seguro mediante una conexión VPN basada en firewall que permite la asistencia remota con rapidez, reduciendo los tiempos de inactividad de la máquina y los costes del servicio
- Interfaz de Software de Diseño, otra de las nuevas opciones que permite la creación de diseños directamente desde un ordenador mediante cualquier software de gestión de diseños.
Aprovechar el conocimiento experto de Wipotec
Como proveedor internacional líder en soluciones fiables de codificación, serialización y agregación, Wipotec ayuda a los fabricantes de productos sanitarios en su misión de cumplir íntegramente con los requisitos UDI. La experiencia tecnológica de nuestra compañía ha quedado demostrada en más de 3000 proyectos de Track and Trace realizados con éxito. Como socio GS1, Wipotec sigue de cerca los cambios normativos globales y proporciona múltiples opciones para mejorar el cumplimiento de la normativa vigente y futura.