Mise en œuvre des exigences de l’UDI grâce à la technologie modulaire et flexible
Compte tenu des pertes de revenus de plusieurs millions d'euros causées chaque année par le détournement de produits et leurs contrefaçons, la mise en œuvre des exigences de l'Identification Unique des Dispositifs médicaux (UDI) au niveau international est une mesure indispensable. L'objectif est de réduire les risques liés à la fraude et d'améliorer le flux de données et la transparence entre toutes les parties prenantes.
En dépit des enjeux à court terme auxquels sont confrontés les fabricants de dispositifs médicaux, tels que des coûts élevés de mise en conformité et une complexité organisationnelle, le système d'Identification Unique des Dispositifs médicaux ainsi que leur traçabilité apporteront des bénéfices à long terme grâce à la réduction de la contrefaçon, la prévention des importations parallèles et le renforcement du contrôle et de la transparence des données.
Sur cette page, vous trouverez des informations sur les sujets suivants :
- Les principes de base du système d'Identification Unique des Dispositifs médicaux (UDI) de l'Union Européenne
- Les exigences de l'UDI dans la perspective mondiale
- La technologie UDI pour la traçabilité des dispositifs médicaux
- Conformité à l'UDI et plus encore : exploiter les avantages des solutions de pointe
Livre blanc : Conformité évolutive : Une perspective mondiale sur l'identification unique des dispositifs
Un accès rapide aux informations sur les produits, une meilleure gestion des retours, une protection plus efficace contre la contrefaçon et les marchés gris : l'identification unique des dispositifs médicaux (UDI) devrait révolutionner l'industrie des dispositifs médicaux. Dans le même temps, elle pose de multiples questions et engendre diverses inquiétudes chez les fabricants de produits et les entreprises d'étiquetage. Il est important de ne pas perdre de vue la perspective mondiale, qui implique de garder à l'esprit tous les développements et changements liés à l'UDI.
Ce livre blanc présente les défis et les facteurs de succès de la mise en œuvre de l'UDI dans une perspective mondiale. Ce document offre aux fabricants de produits et aux entreprises d'étiquetage un aperçu global des derniers développements sur la scène internationale. Il constitue donc une source d'information précieuse pour les fabricants de produits et les entreprises d'étiquetage à l'échelle internationale.
Les principes de base du système d'identification unique des dispositifs médicaux (UDI) de l'Union Européenne
Soucieuses de respecter les exigences de l'UDI et leurs dates d'application, les entreprises spécialisées dans les dispositifs médicaux procèdent à la phase de mise en œuvre, qui consiste à actualiser les lignes de conditionnement avec de nouvelles technologies tout en intégrant davantage de solutions informatiques. Conformément au MDR (Règlement relatif aux Dispositifs Médicaux) et au IVDR (Réglement relatif aux Dispositifs médicaux de diagnostic In Vitro) de l'UE, les fabricants de dispositifs médicaux seront entièrement responsables de la réalisation des étapes suivantes :
Attribution d'UDI aux produits individuels
Sauf quelques très rares exceptions, un Identifiant Unique de Dispositif médical composé des données suivantes est attribué à tout dispositif médical mis sur le marché :
- un Identifiant de Dispositif (UDI-DI) comprenant des informations fixes sur le fabricant et le dispositif ;
- un Identifiant de Production (UDI-PI) comprenant des données de production variables, telles qu'un numéro de série ou un numéro de lot, une date de fabrication et une date d'expiration.
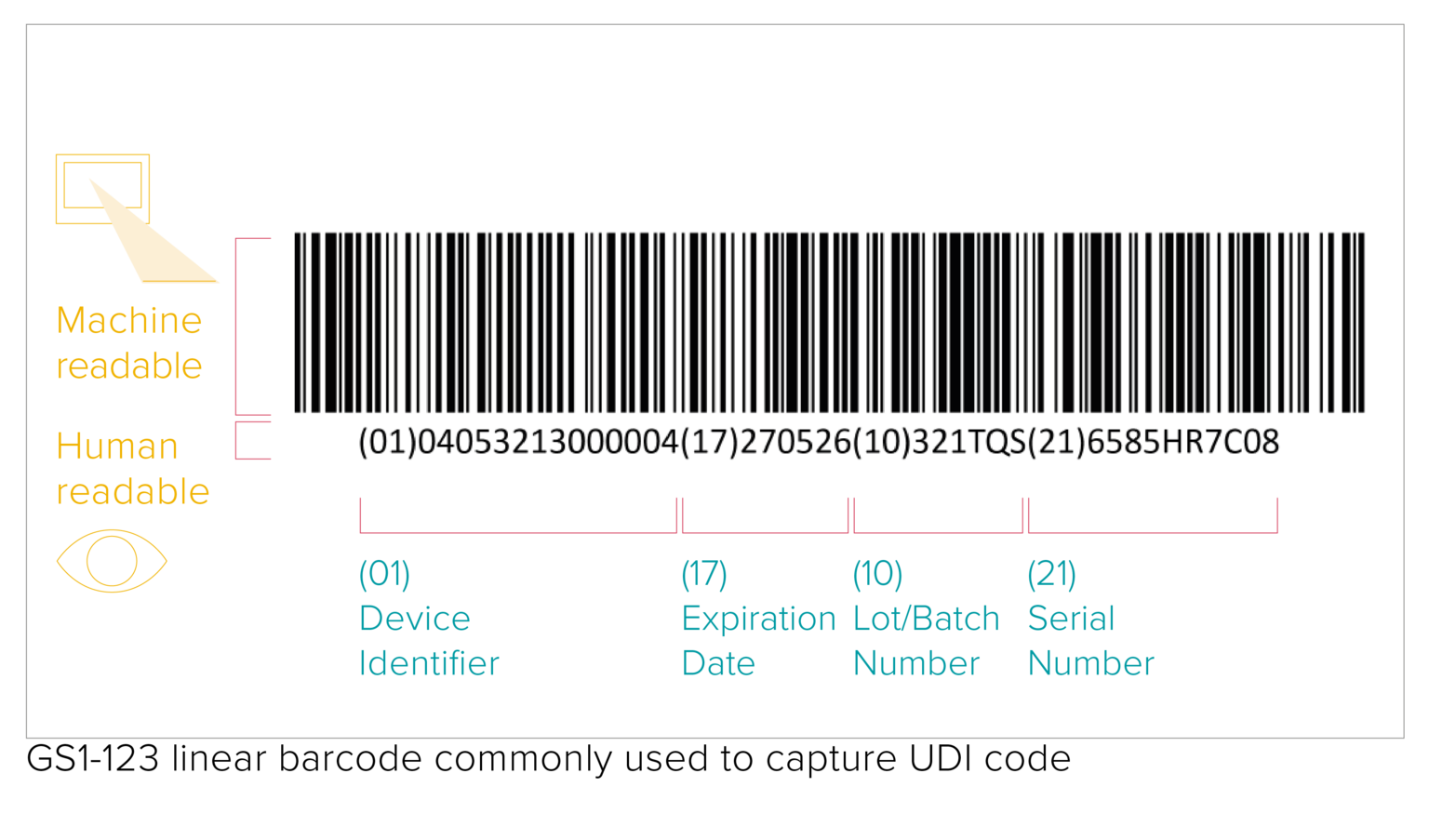
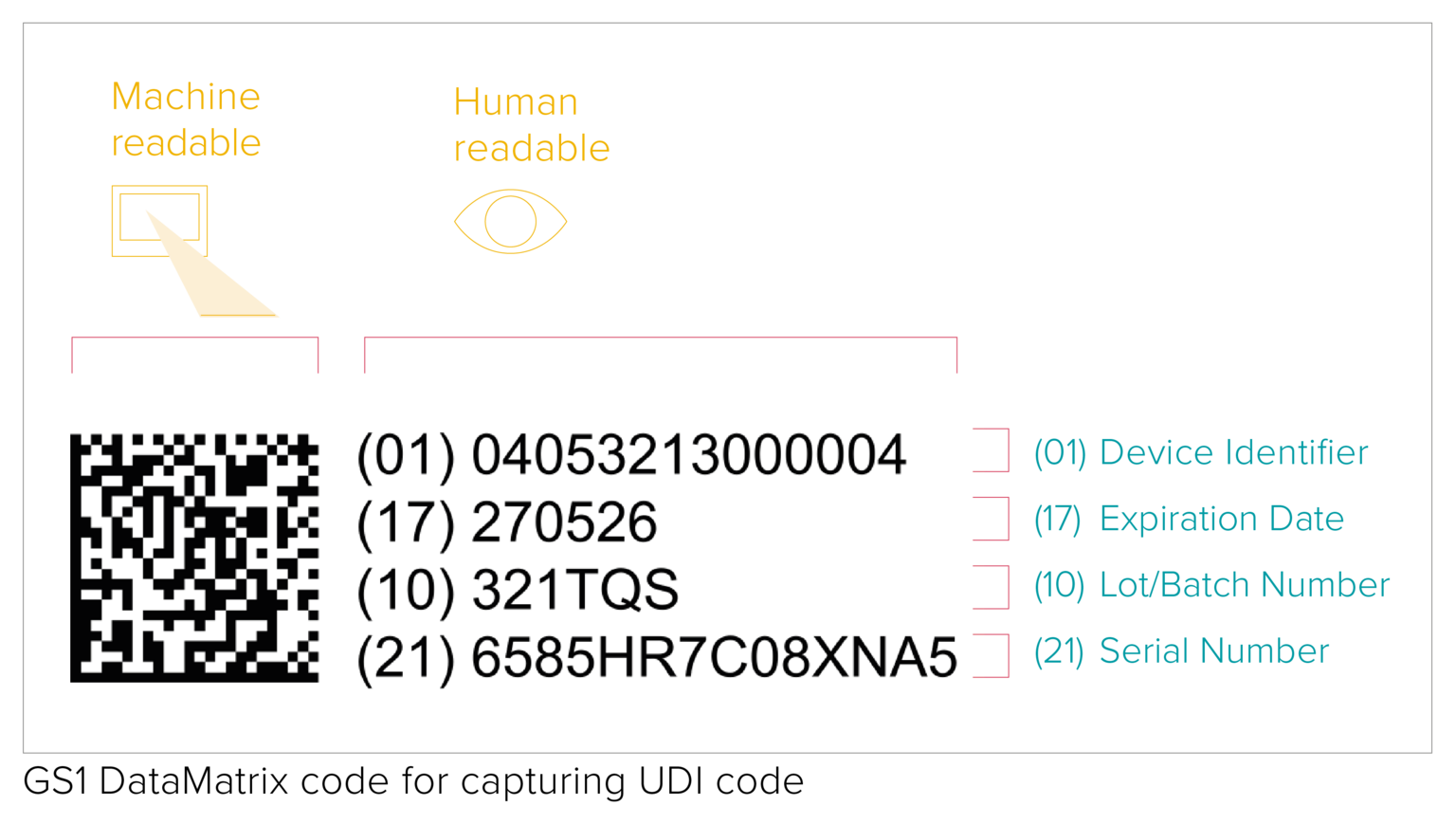
Apposer le code UDI sur un produit et son emballage
Le code UDI correspond à un code lisible par une machine (AIDC) et par l'homme (HRI). L'AIDC désigne la technologie d'Identification Automatisée pour la Saisie de Données et peut être un code-barres linéaire ou un DataMatrix, etc. Comme le précisent la réglementation, le code UDI doit être indiqué directement sur l'appareil dans le cas de produits réutilisables, ou placé sur son étiquette et sur tous les niveaux d'emballage supérieurs.
La qualité d'impression des codes-barres dépend d'un certain nombre de facteurs différents liés à la qualité et aux conditions de stockage des matériaux d'emballage. Si aucune exigence spécifique n'est imposée en matière de vérification des codes-barres UDI, le GS1 demande néanmoins le respect des normes de vérification ISO/CEI afin de garantir la lisibilité des codes-barres par tous les intervenants de la chaîne d'approvisionnement.
Enregistrement et mise à jour des données UDI dans EUDAMED
EUDAMED, une base de données européenne interopérable mise à jour pour la collecte, le renouvellement et l'échange d'informations sur les dispositifs médicaux, constituera un point d'accès pour les organismes de réglementation, les opérateurs économiques, les prestataires de soins de santé et le public.
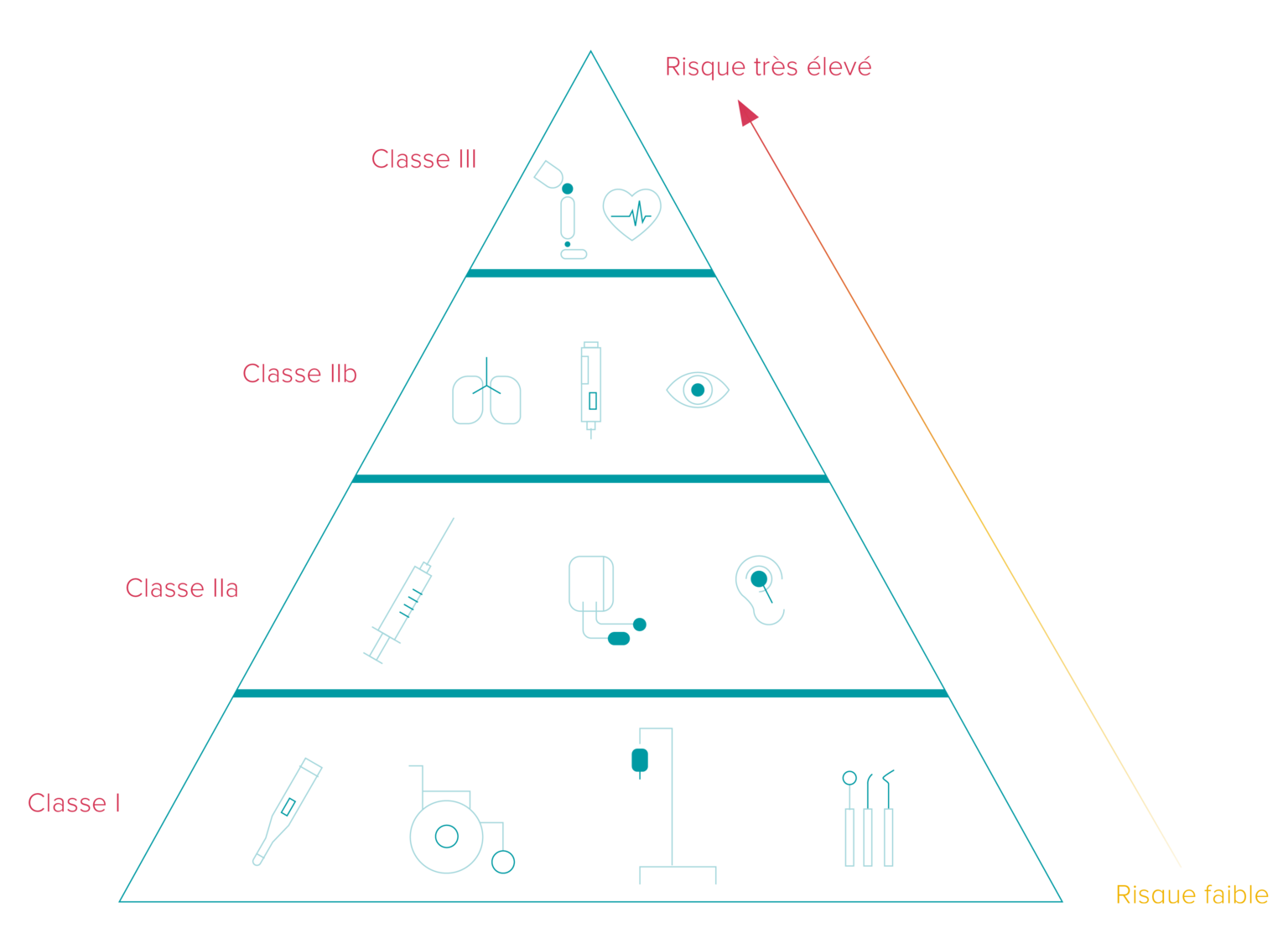
Adhérer au calendrier de conformité de l'UDI
Les délais de mise en œuvre de l'UDI varient en fonction de la classification des dispositifs de diagnostic médical/in vitro en trois catégories différentes correspondant à leurs niveaux de risque. De plus, le délai dépend du fait que le fabricant appose le code UDI sur le dispositif même ou sur son étiquette.
Vous souhaitez en savoir plus sur les exigences de l'UDI pour les fabricants de dispositifs médicaux ?
Les exigences de l’UDI dans la perspective mondiale
Pour permettre la traçabilité des dispositifs médicaux et prévenir le détournement et la contrefaçon des produits, les États-Unis ont été le premier pays à introduire un système mondial d'UDI pour les dispositifs médicaux distribués sur leur marché.
Les exigences de FDA UDI (Food and Drug Administration UDI) sont, pour la plupart, basées sur les directives du Forum International des Régulateurs des Dispositifs Médicaux (IMDRF) avec une base de données nationale centralisée, GUDID, servant de catalogue de référence public pour les produits codés avec UDI.
L'importance de l'identification unique des dispositifs médicaux a également été reconnue dans de nombreux pays des marchés émergents, notamment la Chine, l'Inde, le Brésil, la Corée du Sud, l'Arabie saoudite et Taïwan, pour n'en citer que quelques-uns. Cette évolution mondiale a un impact direct sur la façon dont les fabricants internationaux marquent leurs produits et gèrent les flux de données UDI dans les différentes parties du monde.
Malgré les efforts de l'IMDRF visant à aider à normaliser les exigences en matière d'UDI au niveau mondial, celles-ci sont différentes d'un pays à l'autre à plusieurs égards. Parmi ces différences, on peut citer les aspects suivants :
- Types de supports UDI acceptés
- Marquage et placement du code UDI sur le produit et son emballage
- Exigences pour les données UDI-DI et UDI-PI
- Délais d'application pour les différents groupes de produits
- Événements qui déclenchent une mise à jour des données UDI
- Groupes de produits soumis aux exigences de l'UDI dans différents pays
Ces aspects ont un impact significatif sur le choix d'une solution de conformité UDI qui, compte tenu de l'évolution des réglementations mondiales, doit posséder une grande capacité d'adaptation, être évolutive et flexible.
Sérialisation des dispositifs médicaux
La sérialisation est indispensable à tout système efficace de traçabilité des dispositifs médicaux, mais elle est également une exigence de l'UDI pour les dispositifs médicaux implantables actifs, par exemple les stimulateurs cardiaques, les défibrillateurs et les moniteurs de glucose implantables.
La sérialisation consiste à attribuer un numéro de série unique à chaque produit fini afin qu'il puisse être automatiquement identifié dans un point de vente. L'industrie pharmaceutique déploie déjà la sérialisation comme mesure de lutte contre la contrefaçon au niveau mondial, et cette technologie est en train de prendre de l'ampleur dans d'autres secteurs.
Même les entreprises dont les produits n'entrent pas dans la catégorie des dispositifs médicaux implantables actifs peuvent tirer profit du fait d'équiper leurs lignes de produits d'une technologie flexible qui permet à la fois la conformité à l'UDI et la sérialisation. Cette approche les aidera à maintenir leurs lignes de production prêtes pour l'avenir au cas où la sérialisation deviendrait une exigence UDI impérative pour un plus grand nombre de groupes de produits, ou serait imposée dans certains pays importateurs.
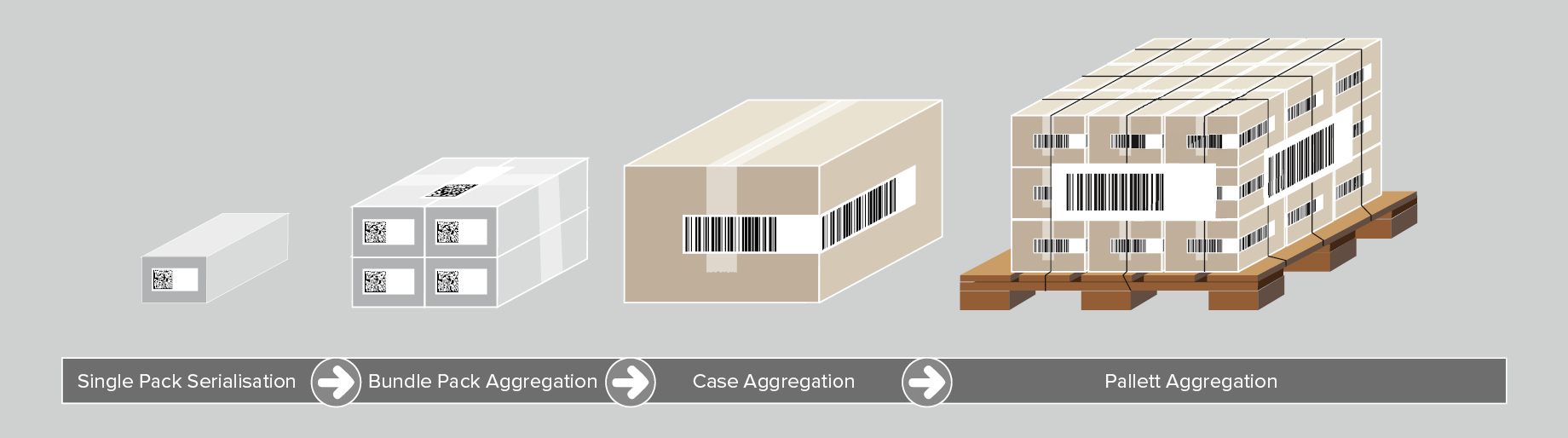
Agrégation des dispositifs médicaux
Bien qu'elle ne soit pas imposée par les exigences de l'UDI, l’agrégation est un autre pilier de la traçabilité optimale des dispositifs médicaux. L’agrégation se réfère à la création d'une hiérarchie parent-enfant entre les différents niveaux de conditionnement des produits, en partant d'un produit individuel jusqu'à une palette. Par exemple, pour regrouper plusieurs produits individuels dans une caisse d'expédition, on procède aux étapes suivantes :
- Un code-barres UDI est scanné pour chaque produit ;
- Les données du code-barres sont regroupées et liées à la caisse d'expédition ;
- La caisse d'expédition est dotée d'une étiquette avec un code-barres UDI comprenant un numéro de série unique.
Ce processus se reproduit pour tous les niveaux d'emballage. Lorsqu'il scanne un code, l'opérateur obtient toutes les informations UDI relatives aux dispositifs médicaux contenus dans la caisse d'expédition.
Avantages de l'agrégation lors des rappels de produits
L'agrégation de produits ne se limite pas à améliorer la traçabilité des dispositifs médicaux, elle peut également optimiser les processus de rappel, de correction ou de retrait des produits. Si un rappel ou un retrait de produit devient nécessaire, les fabricants sont tenus de retirer de la circulation l'ensemble des lots de produits concernés partout où ils se trouvent.
Étant donné que l' agrégation de dispositifs médicaux crée des hiérarchies entre les niveaux de conditionnement, elle permet des retraits de produits plus ciblés et même à l'unité. Cela signifie que les produits peuvent être rappelés ou retirés sur la base de numéros de série au lieu de numéros de lot de fabrication. Cette nouvelle option permet un rappel ou un retrait de produits beaucoup plus rapide et plus ciblé.
Avez-vous des questions concernant l'agrégation des dispositifs médicaux ?
La technologie UDI pour la traçabilité des dispositifs médicaux
Les solutions TQS de Wipotec permettent de se conformer efficacement à l'UDI et apportent une valeur ajoutée grâce à un ensemble de multiples options supplémentaires. En fonction des différents aspects du processus de production et de conditionnement, les fabricants peuvent opter pour des machines autonomes ou des kits OEM. Les deux solutions offrent des performances fiables :
- Étiquetage ou codage conforme à l'UDI sur plusieurs niveaux d'emballage. Qu'ils soient autonomes ou OEM, les équipements TQS peuvent apposer des identifiants uniques sur les étiquettes des dispositifs médicaux et les emballages. Il est également possible d'imprimer les UDI sur des boîtes plates en dehors de la ligne, avant de procéder à l'emballage des dispositifs.
- Vérification et classement des codes-barres UDI. Le système TQS identifie et rejette efficacement les produits dont les codes-barres ne sont pas de bonne qualité afin de garantir que seuls les codes-barres lisibles passent le contrôle de qualité. En outre, le système effectue un classement de la qualité de chaque code-barres imprimé conformément aux exigences de vérification des codes-barres UDI du GS1. Les données relatives à la qualité et au classement des codes-barres attestent que les codes-barres imprimés sont conformes aux normes de qualité ISO/CEI au stade de la fabrication.
- Sérialisation et agrégation de dispositifs médicaux. Les solutions TQS sont des machines modulaires multifonctionnelles qui permettent une traçabilité fiable des dispositifs médicaux. Les machines peuvent non seulement assurer une interopérabilité transparente, mais aussi générer et attribuer de manière autonome des numéros de série aux produits et transférer des données au système du site.
- Une étiquette inviolable (Tamper Evident) est apposée après vérification de la qualité du code. Il s'agit d'un module optionnel disponible à la fois dans les solutions OEM et autonomes. Même si cette option n'est pas une exigence de l'UDI, les étiquettes inviolables garantissent l'intégrité de l'emballage du produit.
- Interfaces ouvertes et interopérabilité. Grâce aux interfaces de communication ouvertes, les équipements TQS peuvent échanger des données UDI avec tout système au niveau du site.
- Le tri pondéral en ligne est une composante optionnelle qui permet un contrôle ultra-précis du poids des produits finis. Ses résultats de pesage très précis indiquent si le conditionnement fini renferme tous les éléments nécessaires. Les produits ayant un poids incorrect sont éjectés. Un écart de poids cible signifie souvent qu'un composant est manquant, tel qu'un dépliant par exemple.
Machines autonomes et Kits OEM
Les machines autonomes de Wipotec sont des solutions de codage, de sérialisation et d'agrégation de dispositifs médicaux, compactes, personnalisables et prêtes à l'emploi, qui peuvent être rapidement intégrées dans des lignes d'emballage. Le programme comprend également des solutions autonomes pour l'impression des codes UDI avant conditionnement.
Les kits TQS OEM composés de plusieurs éléments, tels que des imprimantes, des appareils photo et des étiqueteuses. Modulaire et flexible, une solution OEM peut être configurée en fonction des besoins spécifiques du client. L'équipement OEM est installé dans une machine externe, ce qui en fait une option privilégiée dans les usines disposant de moins d'espace. En tant que solution entièrement automatisée, l'OEM de TQS peut fonctionner à des vitesses de production très élevées.
Conformité à l’UDI et plus encore : exploiter les avantages des solutions de pointe
La technologie TQS est non seulement intuitive et facile à utiliser, mais elle maintient également la productivité globale des lignes de conditionnement et offre des fonctionnalités intelligentes très utiles qui augmentent l'efficacité tout en permettant aux fabricants de se conformer aux exigences UDI.
Fonctionnalités intelligentes TQS :
- Central line management La gestion centrale de la ligne simplifie la tâche de l'opérateur de machine, car celui-ci n'a pas à configurer chaque machine ou ses composants séparément. Tous les paramètres pertinents sont configurés de manière centralisée dans le logiciel de gestion de la ligne.
- ConfigureFast est la fonctionnalité qui permet une configuration et un fonctionnement rapides et intuitifs des composants de codage et d'inspection au moyen d'une seule interface utilisateur.
- Open XML-interfaces assurent la compatibilité avec plus de 80 systèmes au niveau du site (L3 + L4) pour la gestion et le transfert des données.
- TQS Traceability+ permet de recueillir des données supplémentaires, telles que la valeur de classement du code et le poids du produit, qui peuvent être utilisées à de multiples fins afin de déterminer la qualité de la production.
- Secure remote service via une connexion VPN basée sur un pare-feu permet un service à distance rapide, réduisant ainsi les temps d'arrêt des machines et les coûts de service.
- Layout Software Interface L'interface logicielle de mise en page fait partie des fonctionnalités les plus récentes. Elle permet de créer des mises en page directement à partir d'un ordinateur de bureau en utilisant n'importe quel logiciel de gestion de mise en page externe disponible sur le marché.
Profitez du savoir-faire des experts de Wipotec
Wipotec assiste les fabricants de dispositifs médicaux dans leur mise en conformité avec les exigences de l'UDI. L'expertise technologique de l'entreprise a été démontrée dans plus de 3000 projets Track and Trace réussis. En tant que partenaire de GS1, Wipotec suit les évolutions réglementaires mondiales et fournit de multiples fonctionnalités permettant de se conformer aux réglementations mondiales actuelles et futures.