Directivas de falsificación de medicamentos – impedir la falsificación de medicamentos
La seguridad del medicamento es un bien preciado que se pone en peligro continuamente debido a los medicamentos falsificados. Detrás de los medicamentos falsificados puede haber medicinas en las que los ingredientes están declarados incorrectamente o diluidos, o en las que falta alguna sustancia. Utilizando unos envases que parecen auténticos o mediante el envasado posterior en cajas originales, se engaña a los distribuidores y los pacientes sobre el contenido real.
En general, las falsificaciones se fabrican de un modo mucho más barato y se venden como si fuesen preparados auténticos. Según las estimaciones de la organización americana FDA (Food and Drug Administration), más del 10 % de todos los medicamentos en circulación están falsificados. Como consecuencia, pensando que se trata de medicamentos auténticos, los pacientes toman, sin saberlo, sustancias ineficaces o incluso nocivas que podrían tener efectos drásticos para su salud. Los fabricantes honrados de productos farmacéuticos se enfrentan no solo a las pérdidas de ingresos debido a la competencia de medicamentos falsificados baratos, sino también a la disminución de la confianza de los consumidores, que se sienten engañados.
Las directivas de falsificación de medicamentos que requiere la Organización Mundial de la Salud y que han sido incorporadas por muchos países tienen como objetivo la salvaguarda de la salud del paciente. Por tanto, el logro del cumplimiento de dichas regulaciones beneficia a todos los fabricantes farmacéuticos de prestigio.
¿Necesita más información sobre las directivas de falsificación globales? ¡Estaremos encantados de asesorarle!
En esta página le informamos sobre las directivas globales directivas de falsificación de medicamentos:
- Visión general mundial
- Europa (2011/62/UE)
- EE. UU. (DSCSA)
- Brasil (SNCM)
- Implementación de la directiva de falsificación
Directivas de falsificación en todo el mundo: visión general
Overview of falsification guidelines worldwide
Las directivas de falsificación de medicamentos que requiere la Organización Mundial de la Salud y que han sido incorporadas por muchos países tienen como objetivo la salvaguarda de la salud del paciente. Por tanto, el logro del cumplimiento de dichas regulaciones beneficia a todos los fabricantes farmacéuticos de prestigio.
En esta visión general conocerá lo que tienen en común y cuáles son sus particularidades.
- Codificación
- Cierre Tamper-Evident
- Agregación
- GS1 international
Codificación: Otros países, otra identificación de medicamentos
Todas las directivas de medicamentos exigen un número individual de identificación de los envases de medicamentos. Además de esto, la mayoría de las directivas requieren también la fecha de caducidad del medicamento, así como el número de lote y, dado el caso, un número de serie. Sin embargo, el formato con el que se realizan dichas identificaciones puede variar mucho. No obstante, siempre deben contener texto claro y legible para los usuarios, así como un código de barras legible por máquinas. Lo mismo se aplica al tipo de número de identificación del producto: con frecuencia se exige el formato GTIN del GS1, y en algunos casos se especifica también un número de ID con el formato NTIN o con formatos específicos de los países (por ejemplo, PPN en Alemania, CIP en Francia, KDC en Corea, CNK en Bélgica, AIC en Italia, etc.). El número de identificación del producto contiene normalmente la siguiente información: un prefijo del país, el número de la empresa, el número de artículo y una cifra de comprobación.
Cierre Tamper-Evident: particularidad de la Directiva de Falsificación de Medicamentos (FMD)
El cierre tamper-evident se exige para los medicamentos de prescripción obligatoria en países sujetos a la Directiva de Falsificación de Medicamentos de la Unión Europea, que entró en vigor el 9 de febrero de 2019.
La solución para el cierre tamper evident de las cajas de medicamentos:
Agregación: Track & Trace más allá de la cadena de suministro completa
Solo algunas directivas, por ejemplo, en Turquía, exigen una agregación que permita la trazabilidad de un único envase de producto a lo largo de todo el transporte y las diferentes etapas de envasado. Países como EE. UU. se reservan todavía la decisión, y en la UE y algunos otros países la agregación es voluntaria. En Brasil, a partir del año 2021 cada caja deberá ser trazable a lo largo de los distintos niveles de agregación. En este caso, el tipo de codificación también puede ser distinto en los diferentes países. Aunque en algunas directivas de falsificación (como la europea) la agregación es voluntaria desde el punto de vista puramente jurídico, puede ser deseable para clientes como distribuidores mayoristas y farmacias de hospitales. Estos reciben, en algunos casos, grandes suministros de paquetes o palés. La posibilidad de verificar un suministro completo directamente en la recepción de la mercancía les facilita mucho el flujo de productos.
Con nuestras soluciones de agregación TQS-CP y TQS-CP Bottle les proporciona a sus clientes precisamente esto: Medicamentos verificables a nivel de paquetes y de palés. El operador llena la caja de envío capa a capa. Después de cada capa, la cámara integrada registra los códigos de las cajas de medicamentos. Cuando la caja de envío está llena y se ha completado el nivel de agregación, el TQS-CP genera automáticamente la etiqueta correcta. Esto funciona en varios niveles de agregación.
GS1 international: el guardián de los números de identificación
GS1 international, con sede en Bruselas, desarrolla estándares internacionales para diversos sectores y otorga los Global Trade Item Numbers (GTIN), y otros números de identificación para medicamentos. Garantiza la comprensión internacional a través de códigos de barras y números de identificación estandarizados. Gracias a la estrecha colaboración de Wipotec con GS1 Germany y el GS1 Global Healthcare User Group, transmitimos enseguida a nuestros clientes las novedades e implementamos directamente las especificaciones relevantes.
La Directiva de falsificación 2011/62/UE y sus implicaciones para los fabricantes de la UE
En 2011 se publicó la Directiva de Falsificación de Medicamentos (FMD) 2011/62/UE. Es aplicable a todos los medicamentos de prescripción obligatoria y a ciertos medicamentos sin receta médica de la Unión Europea desde febrero de 2019. Islandia y Noruega, que no pertenecen a la Unión Europea, también están sujetas a la Directiva Europea de Falsificación de Medicamentos. Italia, Bélgica y Grecia serializados antes de febrero 2019. Sin embargo, no lo hacen de acuerdo con la Directiva Europea, sino utilizando viñetas o «Bollini». Tienen otros seis años para implementar completamente las Directivas Europeas. Aquellos medicamentos que no posean las características de seguridad necesarias de acuerdo con la FMD (Directiva de Falsificación de Medicamentos) de la UE ya no podrán venderse en la UE. En la práctica, en la farmacia se escanea cada envase individual cuando se entrega a los pacientes. Si el escáner indica un mensaje de error, el medicamento no se puede entregar.
¿Necesita más información sobre la FMD de la UE?
- Número de identificación del producto, en el formato GTIN, NTIN (o PPN para Alemania)
- Número de lote
- Fecha de caducidad
- Número de serie individual del estuche individual
- Dado el caso, números de producto internacionales con fines de reembolso por parte de los seguros médicos nacionales (national healthcare reimbursement number, NHRN)
Además, los estuches individuales deben estar protegidos contra la manipulación, mediante un precinto Tamper-Evident intacto.
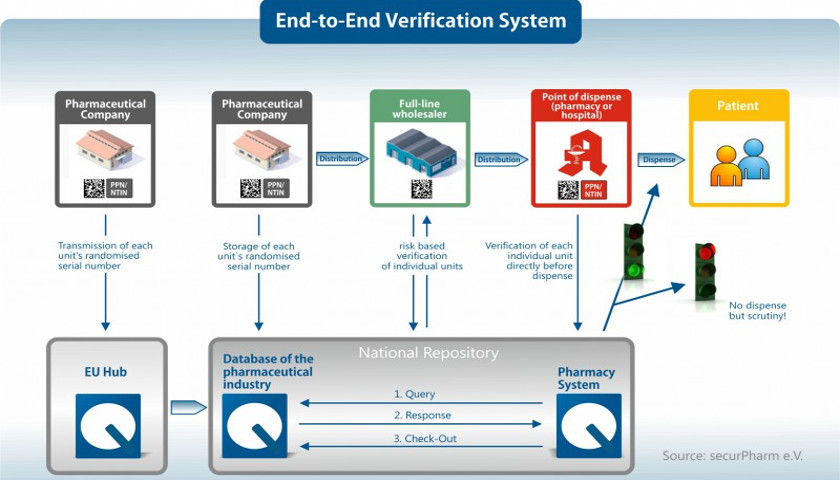
securPharm: el sistema nacional de verificación
securPharm: el sistema nacional de verificación garantiza medicamentos seguros en Alemania
En cuanto se escanea en la farmacia el envase de un medicamento, el código leído se compara con una base de datos online para verificar que se trata de un medicamento seguro legal. Los países europeos ya han creado sistemas nacionales en sus idiomas respectivos, en los cuales están guardados los datos correspondientes. En Alemania, el sistema se llama securPharm. Al introducirla con securPharm, la identificación nacional estándar, el Pharmazentralnummer (PZN), que suele estar contenida en un código de barras y que antes era común en Alemania, va incluida en el Número Nacional de Producto Comercial (NTIN) o en el Número-de Producto-Farmacéutico (PPN) prescritos por la Directiva Europea de Prevención de Falsificaciones. . Se incluirá en el código de matriz 2D junto con otra información necesaria.
Fuente: securPharm e.V.: Reglas para la codificación de medicamentos de verificación obligatoria en el mercado alemán
European Medicines Verification Organisation (EMVO)
Identificar medicamentos en todo el mundo con ayuda de la EMVO
Las bases de datos nacionales se agrupan en un nodo europeo desde 2015. Esto garantiza la comparabilidad de los datos a nivel europeo y permite el comercio intracomunitario de productos farmacéuticos seguros. Este nodo europeo está bajo la tutela de la "European Medicines Verification Organisation" (Organización europea para la verificación de medicamentos, EMVO), que amplía y ejecuta el proyecto. Los fabricantes de productos farmacéuticos introducen los datos necesarios directamente en la base de datos europea que, a su vez, se comunica con las bases de datos nacionales. El establecimiento de bases de datos nacionales e internacionales finalizó en 2019, a tiempo para la entrada en vigor de la Directiva Europea de Falsificaciones.
DSCSA, la Ley de cadena de suministro de medicamentos (Drug Supply Chain Security Act) se encarga de la seguridad de los medicamentos en los EE. UU.
La directiva de falsificaciones estadounidense DSCSA forma parte de la DQSA ("Drug Quality Security Act", Ley de cadena de suministro de medicamentos) de la FDA. Fue promulgada por el presidente en el año 2013 y debe implementarse por completo hasta 2023. Desde 2015, los fabricantes y distribuidores de medicamentos de prescripción obligatoria y reembolsables están obligados a proporcionar la información necesaria a nivel de lotes y a documentar todos los datos de las transacciones hasta la entrega final del medicamento en la farmacia. Gracias a la trazabilidad sin fisuras de los números de lote de los medicamentos, se pueden detectar y confiscar rápidamente no solo los lotes de medicamentos falsificados, sino también los robados. Se aplican unos plazos escalonados para diferentes interesados, fabricantes, proveedores de servicios de envasado, mayoristas y vendedores. A partir de noviembre de 2023, se extenderá esta obligación al etiquetado de medicamentos en estuches individuales. El periodo de transición para el etiquetado de estuches individuales dio comienzo en noviembre de 2018. Las disposiciones correspondientes se aplicaban hasta ahora en determinados estados federados, y ahora son reemplazadas por la regulación aplicable en todo el país.
¿Necesita más información sobre la DSCSA?
A partir de noviembre de 2018, en cada estuche individual deberá indicarse la siguiente información en forma de código de matriz 2D y en texto claro:
- Número nacional de identificación del producto en formato GTIN
- Número de serie individual del estuche individual
- Fecha de caducidad del medicamento
- Denominación del lote del medicamento
Serialización de frascos de HDPE
Serialización de frascos de HDPE en EE. UU.
Además de la implementación de la Directiva DSCSA, los fabricantes y envasadores para el mercado estadounidense se enfrentan a otro desafío: los frascos de HDPE habituales en EE. UU. para pastillas y cápsulas. A diferencia de los estuches con blísters usuales en Europa, estos plantean unos requisitos totalmente distintos a la logística de los fabricantes. Esto incluye también los llamados "Helper-Codes" o códigos auxiliares. Se indican en la tapa o en el fondo de los frascos para su agregación en fardos más grandes. Se puede realizar también con tinta UV "invisible". El "Helper-Code" permite la identificación de los envases, incluso si las etiquetas individuales ya no se pueden leer debido al enfardado. /p>
La serie Bottle de Wipotec imprime e inspecciona frascos y viales de manera fiable. Encentre su solución para la inspección de productos, la serialización fiable y la agregación semiautomática de frascos y viales, para cumplir los requisitos de la directiva americana de falsificación DSCSA.
Inspección total ultrarrápida – Serialización compacta – Agregación semiautomática – Impresión de "Helper-Codes"
Identificación de medicamentos con E-Pedigree
Trazabilidad de la identificación de medicamentos en todos los EE. UU. con E-Pedigree
En cierto modo, el E-Pedigree es el equivalente americano del sistema EMV europeo. En este "árbol genealógico electrónico" están guardados todos los datos de un preparado, incluidos los datos de transacciones que se recopilan a lo largo de la cadena de suministro de un producto farmacéutico. En este caso, también hay bases de datos de menor volumen a nivel de los estados federados, que se agrupan en una base de datos internacional. Muchas de las bases de datos de los estados federados se basan en el sistema del estado pionero de Florida, que ya introdujo el E-Pedigree en 2005.
Directiva sobre falsificación en Sudáfrica: serialización de envasado secundario y terciario
Directiva de falsificación de medicamentos en Brasil: Track & Trace con SNCM
El organismo sanitario brasileño ANVISA ha dado un paso más. En 2014 promulgó las normas abreviadas como SNCM para un sistema de Track & Trace, con el que se supervisa la fabricación y la cadena de suministro de los medicamentos. De forma similar a los sistemas europeos y americanos, también en este caso se imprime en los envases el número de identificación del producto, el número de serie, el número de lote y la fecha de caducidad de los medicamentos. Tras algunos retrasos en su puesta en práctica, la regulación vigente actualmente especifica el 1 de abril de 2022 como fecha límite para la implementación completa del "Sistema Nacional de Controle de Medicamentos".

Sudáfrica se ha unido a la lucha global contra la falsificación de los medicamentos. Las exportaciones farmacéuticas de la UE a Sudáfrica superan el billón de euros anuales, lo que hace que las recientes directivas sudafricanas sobre codificación y serialización supongan un gran cambio para los fabricantes farmacéuticos europeos. Las empresas que hagan envíos a Sudáfrica tendrán que reorganizar sus procesos de envasado para cumplir con los requisitos. Se espera que, para 2022, se habrá completado la serialización del envasado secundario y terciario. La implementación gradual de la regulación tiene como objetivo otorgar suficiente tiempo a las compañías farmacéuticas para que puedan prepararse.
Implementación de las directivas de falsificación: ¿cómo lo consiguen los envasadores y los profesionales de la industria farmacéutica?
La implementación de las directivas nacionales e internacionales de falsificación supone un gran reto para los fabricantes farmacéuticos y para los proveedores de servicios de envasado, tanto técnicamente, como en lo que se refiere a la mentalidad de la empresa. Wipotec puede ayudarle a superar estos obstáculos, ofreciéndole soluciones a medida y numerosa información. Sobre todo, la condición de no identificar solo cada lote, sino cada envase individual, hace que en muchos casos sea necesario adaptar la línea de producción y adquirir nuevos equipos. Por tanto, los fabricantes y los envasadores se enfrentan a numerosos inconvenientes.
Actuación de los directivos
El cumplimiento de la regulación requiere una cooperación efectiva
En el día a día de muchas empresas, observamos que la adaptación de la línea de producción plantea en muchas ocasiones algo más que un "simple" problema técnico que pueda solucionar el jefe de producción por su cuenta. Para encontrar una solución perfecta, que sea adecuada tanto para los requisitos de los países de destino como para las condiciones de la propia empresa, con frecuencia es necesario hablar con varios proveedores. Los fabricantes contratados han de ponerse en contacto con sus clientes y socios con la suficiente antelación, porque, a menudo, encontrar la mejor solución lleva tiempo. El reto es reconocer la prioridad extremadamente alta de estas cuestiones y garantizar el suficiente tiempo para aclararlas. Hay que emprender varias tareas al mismo tiempo, no solo las soluciones variables para la codificación e identificación de envases y lotes, sino también el procesamiento y la transmisión de datos a las bases de datos nacionales.
En este sentido, las soluciones de Wipotec ofrecen una ventaja decisiva: gracias a las interfaces abiertas de nuestras máquinas, son compatibles con las soluciones de software de varios proveedores de servicios Level 3.
¡Obtenga más información sobre las ventajas de las interfaces XML abiertas!
¿No puede esperar más?¡El TQS Fast Track es la solución Plug-and-Play para la serialización totalmente automática en un plazo de 6 semanas!
Calidad de impresión y gestión de datos
Los requisitos en cuanto a calidad de impresión y gestión de datos requieren inversiones
No hay que subestimar el coste de la inversión necesaria para encontrar, adquirir e integrar las soluciones adecuadas. La impresión de envases con códigos e inscripciones duraderos y de alta resolución que siempre se puedan leer por máquinas es un reto considerable. Las altas velocidades hacen que sea necesario utilizar tecnologías adecuadas para el transporte de productos, con el fin de evitar que se borre la impresión. Además, debe garantizarse la resistencia a la luz y a la abrasión sobre diferentes bases, de modo que esté asegurada la legibilidad de los códigos durante toda la vida útil del producto. La única manera de evitar que los sistemas de reconocimiento rechacen los productos es conseguir un alto grado de coincidencia. Sobre todo en el caso de los códigos pequeños con gran densidad, es imprescindible el uso de sistemas adecuados de impresión y transporte para garantizar la calidad necesaria de la identificación a altas velocidades de impresión.
Para asegurar el cumplimiento de las directivas de falsificación, los fabricantes de productos farmacéuticos y los proveedores de servicios de envasado no deben ahorrar en el lugar equivocado. El rendimiento de la inversión es la perspectiva continua de comercialización.
Flexibilidad
Un mercado internacional necesita un alto grado de flexibilidad
Los fabricantes que suministran a varias regiones desde una misma fábrica deben tener suficiente flexibilidad para para los distintos formatos y diseños de impresión. Esto significa también que la línea de empaquetado y sus unidades de impresión deben poder adaptarse de rápidamente y sin errores a las respectivas directivas de falsificación. Para ello, los fabricantes deben crear el conjunto de datos individual para cada producto y, a continuación, cargarlo en el respectivo sistema de base de datos nacional o internacional. La interfaz de usuario fácil de manejar de las soluciones de Wipotec, con la función de software ConfigureFast, permiten el ajuste rápido y sin errores de los códigos específicos de los países, sin que se retrase la producción. El software flexible permite cambiar de código fácilmente. El LineManager integrado guarda primero todos los datos de producción en la memoria intermedia local, y los transmite al sistema Level 3 conectado. La memoria temporal asegura sus datos contra la pérdida en caso de fallo de corriente y otros imprevistos.
Soluciones compactas con poco espacio: Track & Trace en el Fast Track
En las líneas de producción y empaquetado de los fabricantes de productos farmacéuticos y envasadores por contrato no suele sobrar espacio. Las máquinas muy compactas de Wipotec facilitan la integración de funciones importantes en las líneas existentes ocupando el mínimo espacio. Y lo mejor es que con nuestras soluciones Fast Track su serialización está lista en tan solo 6 semanas.
El TQS-SP permite la serialización y el etiquetado Tamper-Evident de envases individuales de medicamentos en el mínimo espacio. Con el TQS-HC-A con Tamper Evident realiza tres tareas de forma totalmente automática en una longitud de 1800 mm: pesaje de control, serialización y etiquetado.
Ventajas para usted:
- Cumplimiento fiable de las directivas internacionales de falsificación
- También cuando se dispone de poco espacio
- Solución en un plazo de seis semanas desde el pedido
- Modular, escalable e integrable sin problemas en líneas existentes
Descubra ahora las soluciones de serialización más compactas para el mercado de la UE!
It’s worth seeing the international falsification directives as an opportunity to optimise your business performance and contribute to patient protection.
- Full compliance with the FMD will guarantee your continued marketability.
- You’ll be one step ahead of your competitors due to your flexibility with our solutions.
- The traceability of products required by the falsification directives will provide you with valuable Track & Trace data on the efficiency of your supply chain and sales – allowing you to control and optimise your operations.
Find the right solution for your application now!
Successful solutions for the pharmaceutical industry: Find out more about customer projects with Wipotec.



![[Bitte in "Español" übersetzen:] TQS-CP for semi-automatic aggregation of drugs [Bitte in "Español" übersetzen:] TQS-CP drug aggregation](/fileadmin/wipotec-ocs/en/applications/serialisation-pharma/Falsified-medicines-directives/tqs-cp-aggregation-drugs.jpg)


![[Bitte in "Español" übersetzen:] Product identification number PPN [Bitte in "Español" übersetzen:] Product identification number PPN](/fileadmin/wipotec-ocs/en/applications/serialisation-pharma/Falsified-medicines-directives/pharmaceutical-product-identification-number-ppn.jpg)


![[Bitte in "Español" übersetzen:] TQS-SP: User-friendly serialisation in the smallest of spaces [Bitte in "Español" übersetzen:] TQS-SP: User-friendly serialisation](/fileadmin/wipotec-ocs/en/applications/serialisation-pharma/Falsified-medicines-directives/tqs-sp-user-friendly-serialisation.jpg)
![[Bitte in "Español" übersetzen:] TQS-HC-A: Serialisation, weight inspection and tamper-evident [Bitte in "Español" übersetzen:] TQS-HC-A: Serialisation, weight inspection, tamper-evident](/fileadmin/wipotec-ocs/en/applications/serialisation-pharma/Falsified-medicines-directives/tqs-hc-a-tamper-evident.jpg)