Directives sur les médicaments falsifiés – empêcher la falsification des médicaments
La sécurité des médicament est un bien précieux régulièrement mis en danger par des médicaments falsifiés. Derrière les médicaments falsifiés peuvent se cacher des médicaments avec des ingrédients mal déclarés, dilués ou manquants. Un emballage à s'y méprendre ou un réemballage dans des étuis d'origine induisent les commerçants et les patients en erreur sur le contenu réel.
Généralement, les falsifications sont fabriquées et vendues à un prix nettement inférieur à celui des vraies préparations. D'après une estimation de la FDA (agence américaine des produits alimentaires et médicamenteux), plus de 10 % de tous les médicaments en circulation dans le monde seraient falsifiés. Les conséquences possibles : pensant avoir à faire à de vrais médicaments, les patients prennent sans le savoir des substances inefficaces voir nocives, pouvant avoir des conséquences dramatiques sur leur santé.
Les producteurs pharmaceutiques honnêtes ne subissent pas seulement des pertes de chiffre d'affaires en raison des produits concurrents falsifiés à bas coût, mais aussi des pertes de confiance de la part des consommateurs qui se sentent trompés. Les directives sur les médicaments falsifiés exigées par l'Organisation Mondiale de la Santé et introduites actuellement par de nombreux états visent à protéger la santé des patients. De ce fait, une mise en conformité est dans l'intérêt de tous les producteurs pharmaceutiques sérieux.
Avez-vous besoin de plus d'informations sur les directives médicaments falsifiés mondiales? Nous vous conseillons volontiers!
Sur cette page, nous vous informons des directives mondiales directives sur les médicaments falsifiés:
- Aperçu mondial
- Europe (2011/62/UE)
- USA (DSCSA)
- Afrique du Sud
- Brésil (SNCM)
- Mise en œuvre de la directive médicaments falsifiés
Directives sur les médicaments falsifiés dans le monde – un aperçu
Overview of falsification guidelines worldwide
Depuis plusieurs années, et dans le monde entier, les législateurs luttent contre contrent résolument les dangers que représentent les médicaments falsifiés pour les consommateurs et les entreprises, en adoptant des directives nationales et supranationales concernant les médicaments falsifiés. Une mise en conformité avec les règlements permet aux fabricants pharmaceutiques et aux prestataires d'emballage de s'assurer de la poursuite de la commercialisation de leur produits sans heurt, tout en permettant le retrait efficace du marché des produits falsifiés vendus à bas prix. Il existe de nombreuses directives de falsifications de par le monde, et ce à différents stades de l’implémentation et avec des exigences qui peuvent varier.
Cet aperçu vous informe des points communs et des particularités.
- Marquage
- Tamper-evident
- Aggregation
- GS1 international
Marquage: À chaque pays son marquage des médicaments
Toutes les directives médicaments falsifiés demandent un numéro d'identification de produit personnalisé sur les emballages des médicaments. À cela s'ajoutent pour la plupart des directives la date de péremption du médicament ainsi que le numéro de lot et, le cas échéant, un numéro de série. Toutefois, le format de ces marquages peut fortement varier d'une directive à l'autre. Cependant, le texte en clair, lisible par un être humain, ainsi qu'un code à barres lisible par une machine doivent toujours être inscrits. Il en va de même pour le type du numéro d'identification du produit – souvent le format GTIN de GS1 est demandé, de temps à autre la consigne est aussi un numéro d'identification au format NTIN ou dans des formats spécifiques au pays (tels que PPN en Allemagne, CIP en France, KDC en Corée, CNK en Belgique, AIC en Italie, etc.). Le numéro d'identification du produit contient habituellement les informations suivantes: Un préfixe du pays, le numéro de l'entreprise, le numéro d'article et une clé de vérification.
Tamper evident: Particularité de la directive européenne « Médicaments Falsifiés »
Le sceau inviolable (tamper evident) est exigé pour les médicaments soumis à prescription médicale ,dans les pays soumis à la Directive Européenne « Médicaments Falsifiés » à partir du 9 février 2019. Le sceau empêche une manipulation ultérieure du médicament emballé ou une dissimulation de médicaments falsifiés dans des emballages d'origine. Si le sceau est endommagé ou ouvert au moment de la vente, le médicament ne doit pas être remis au client.
La solution pour une fermeture inviolable des boîtes de médicaments:
Agrégation: Track & Trace sur l'ensemble de la chaîne logistique
Une agrégation permettant la traçabilité d'un seul emballage de produit sur l'ensemble du transport et plusieurs niveaux d'emballage n'est exigée que par certaines directives, p. ex. en Turquie. Des pays comme les États-Unis se réservent encore une décision ; dans l'UE et certains autres pays, l'agrégation est volontaire. Au Brésil, chaque boîte individuelle doit pouvoir être traçable sur les différents niveaux d'agrégation à partir de 2021. Là aussi, le type de marquage peut être différent selon le pays. Bien que l'agrégation soit volontaire d'un point de vue purement juridique dans certaines directives médicaments falsifiés – comme dans la directive européenne – elle peut être souhaitée par des clients tels que les grossistes et les pharmacies d'hôpitaux. Ils réceptionnent parfois de grandes livraisons de l'ordre du paquet ou de la palette. La possibilité de vérification d'une livraison complète directement à la réception des marchandises leur facilite grandement le flux de marchandises.
Mit unseren Aggregations-Lösungen TQS-CPet TQS-CP Bottle vous mettez exactement cela à la disposition : Des médicaments vérifiables au niveau du paquet et de la palette. L'opérateur remplit le carton d'expédition couche par couche. Après chaque couche, une caméra intégrée saisit les codes des boîtes de médicaments. Lorsque le carton est rempli et le niveau d'agrégation terminé, TQS-CP crée automatiquement la bonne étiquette. Cela fonctionne sur plusieurs niveaux d'agrégation.
GS1 international – gardien des numéros d'identification
L'organisme GS1 international sis à Bruxelles conçoit les normes mondiales pour différents secteurs et attribue les numéros d'article commercial international (GTIN) ainsi que d'autres numéros d'identification pour les médicaments. Il assure la concertation internationale sur des codes à barres et des numéros d'identification normalisés. Grâce à l'étroite collaboration de Wipotec avec GS1 Allemagne et le GS1 Global Healthcare User Group, nous transmettons rapidement les novations à nos clients et mettons directement en œuvre les consignes importantes.
directive « Médicaments Falsifiés » 2011/62/UE et ce qu'elle signifie pour les fabricants de l'UE
En 2011 a été publiée la directive européenne « Médicaments Falsifiés » 2011/62/UE. Elle s'applique depuis février 2019 à tous les médicaments soumis à prescription médicale et à certains médicaments sans ordonnance dans l'Union Européenne. Les pays non membres de l'UE, l'Islande et la Norvège, seront également soumis à la Directive Européenne sur les Médicaments Falsifiés. L'Italie, la Belgique et la Grèce sérialisaient déjà avant février 2019. Toutefois pas selon la directive européenne, mais à l'aide de vignettes ou de « bollini ». Ces pays disposeront de six ans supplémentaires pour mettre en œuvre entièrement les directives européennes. Les médicaments qui ne respecteront pas les dispositifs de sécurité nécessaires EU FMD (Directive sur les Médicaments Falsifiés) après la date butoir ne pourront plus être commercialisés dans l'UE. Dans la pratique, l'emballage individuel sera scanné par le pharmacien lors de la délivrance au patient. Si le scan donne un message d'erreur, le médicament ne doit pas être délivré.
Vous avez besoin d'autres informations sur EU-FMD ?
- Numéro d'identification du produit, au format GTIN, NTIN (ou PPN pour l'Allemagne)
- Numéro de lot
- Date de péremption
- Numéro de série individuel de l'emballage individuel
- Le cas échéant, numéros de produit nationaux à des fins de remboursement par des caisses de sécurité sociale nationales (national healthcare reimbursement number, NHRN)
En outre, les emballages individuels doivent être protégés contre les manipulations à l'aide d'un sceau d'inviolabilité (tamper evident) intact.
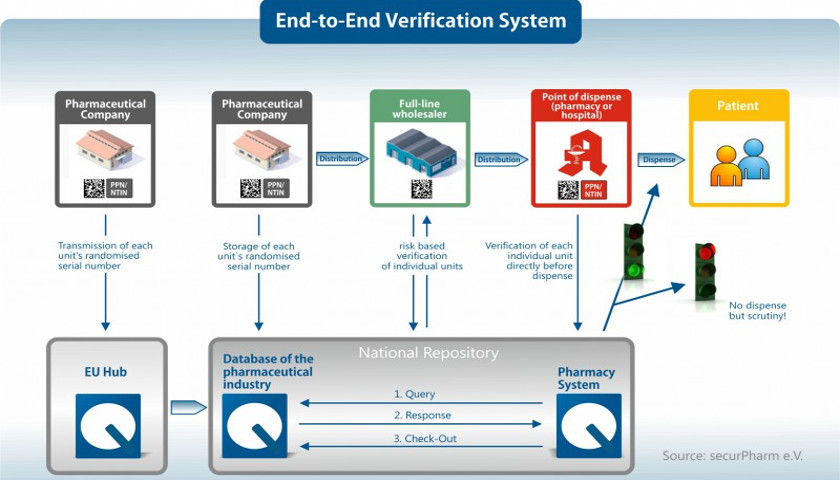
securPharm: Un système de vérification national
securPharm: Un système de vérification national garantit des médicaments sûrs en Allemagne
Dès qu'une boîte de médicaments est scannée en pharmacie, le code lue est comparé à une base de données en ligne pour vérifier qu'il s'agit d'un médicament sûr et légal. Les états européens ont chacun créé des systèmes nationaux dans leur langue respective, dans lesquels les données correspondantes sont enregistrées. En Allemagne ce système s'appelle securPharm. Le numéro pharmaceutique central (PZN, Pharmazentralnummer) , généralement contenu dans le code barre et jusqu'à présent utilisé en Allemagne, sera intégré dans le numéro d'identification de produit NTIN ou PPN prescrit par la Directive Européenne de Prévention contre la Falsification. Il est inscrit avec les autres informations nécessaires dans le code matriciel 2D.
Source : securPharm e.V. : Règles de marquage des médicaments soumis à vérification sur le marché allemand
European Medicines Verification Organisation (EMVO)
Identifier des médicaments à travers toute l'UE grâce à l'association EMVO
Depuis 2015, les bases de données nationales sont regroupées en un nœud européen. Cela permet de comparer les données à travers toute l'Europe et permet ainsi un commerce intracommunautaire de produits pharmaceutiques sûrs. Cette plateforme européenne est chaperonnée par la European Medicines Verification Organisation, EMVO (organisation européenne de vérification des médicaments), qui poursuit l'extension et l'exploitation du projet. Les fabricants de produits pharmaceutiques injectent directement leurs données dans la base de données européenne qui communique avec les bases de données nationales. La création des bases de données nationales et internationales doit être terminée d'ici 2019, à temps pour l'entrée en vigueur de la Directive Européenne de Falsification.
DSCSA – la loi sur la sûreté de la chaîne d'approvisionnement en médicaments (Drug Supply Chain Security Act) veille à la sûreté des médicaments aux États-Unis
La directive étasunienne sur les médicaments falsifiés, DSCSA, fait partie de la DQSA (Drug Quality Security Act, loi sur la sûreté de la qualité des médicaments) de la FDA. Elle a été signée en 2013 par le président et doit être entièrement mise en œuvre d'ici 2023. Depuis 2015 déjà, les fabricants et détaillants de médicaments soumis à prescription médicale ou remboursables ont l'obligation de mettre à disposition les informations nécessaires par lot, et d'enregistrer toutes les transactions jusqu'à la délivrance finale en pharmacie. Grâce à la traçabilité sans faille des numéros de lots de médicaments, il est possible de détecter rapidement des lots de médicaments falsifiés ou volés et de les mettre en sécurité. Des délais échelonnés s'appliquent pour les différentes parties prenantes, producteurs, prestataires d'emballage, grossistes et vendeurs. À partir de novembre 2023, l'obligation s'étendra au marquage des emballages individuels des médicaments. La période de transition pour le marquage des emballages individuels a débuté en novembre 2018. Auparavant, des prescriptions correspondantes s'appliquaient dans certains états fédéraux, elles sont désormais remplacées par le règlement étasunien.
Vous avez besoin d'autres informations sur DSCSA?
Voici les indications qu'exige la DSCSA
À partir de novembre 2018, les informations suivantes devront figurer sous forme d'un code matriciel 2D et en clair sur chaque emballage individuel:
- Numéro national d'identification de produit au format GTIN
- Numéro de série individuel de l'emballage individuel
- Date de péremption du médicament
- Désignation du lot du médicament
La sérialisation de flacons en HDPE
La sérialisation de flacons en HDPE aux États-Unis :
Outre la mise en œuvre de la directive DSCSA, les fabricants et emballeurs pour le marché étasunien ont un autre défi à relever : Les flacons en HDPE pour cachets et gélules habituels aux États-Unis. Contrairement aux étuis remplis de blisters usuels en Europe, ces flacons posent des exigences totalement différentes à la logistique des fabricants. En font entre autre partie les codes auxiliaires (Helper-Codes). Ils sont appliqués sur le couvercle ou le fond des flacons pour leur agrégation en fardeau plus importants. Cela peut aussi être « invisible » avec de l'encre UV. Le code auxiliaire permet d'identifier les emballages, même si les étiquettes individuelles des flacons ne sont plus lisibles par l'agrégation.
La gamme Bottle de Wipotec imprime et inspecte les flacons et les bouteilles de manière efficace. Trouvez votre solution pour l'inspection de produits, la sérialisation efficace et l'agrégation semi-automatique de bouteilles et de flacons pour répondre aux exigences de la directive médicaments falsifiés DSCSA américaine.
Inspection à 360° ultra rapide – sérialisation compacte – agrégation semi-automatique – impression de codes auxiliaires
Du marquage des médicaments à l'aide de E-Pedigree
Traçabilité à travers l'ensemble des États-Unis du marquage des médicaments à l'aide de E-Pedigree
E-Pedigree est en quelque sorte le pendant américain au système EMV européen. Cet « arbre généalogique électronique » contient toutes les données d'une préparation, y compris les données de transactions rassemblées tout au long de la chaîne logistique d'un produit pharmaceutique. Il existe, ici aussi, des bases de données plus petites au niveau des états fédéraux, rassemblées en une base de données internationale. De nombreuses bases de données fédérales sont basées sur le système du précurseur, la Floride, qui a introduit E-Pedigree dès 2005.
La directive anti-contrefaçon en Afrique du Sud: production en série des emballages secondaires et tertiaires
Directive sur les médicaments falsifiés au Brésil: Track & Trace avec SNCM
L'administration sanitaire brésilienne ANVISA est déjà à l'étape suivante. En 2014 elle a promulgué les réglementations abrégées SNCM pour un système Track & Trace qui surveille la fabrication et la chaîne logistique des médicaments. Comme pour les systèmes européen et américain, un numéro d'identification du produit, un numéro de série, un numéro de lot et la date de péremption des médicaments doivent être imprimés sur les emballages. Après quelques retards dans la mise en œuvre, la réglementation en vigueur indique le 1er avril 2022 comme délai de mise en place complète du « Sistema Nacional de Controle de Medicamentos ».

L’Afrique du Sud a rejoint la bataille mondiale contre les médicaments contrefaits. Les exportations pharmaceutiques de l’UE vers l’Afrique du Sud dépassent 1 milliard d'euros par an, ce qui fait des récentes directives de marquage et de production en série en Afrique du Sud un changement majeur pour les fabricants pharmaceutiques européens. Les sociétés fournissant l’Afrique du Sud devront réorganiser leurs processus d’emballage pour répondre aux exigences. La production en série des emballages secondaires et tertiaires devra être achevée d’ici 2022. La mise en œuvre progressive de la réglementation vise à donner aux entreprises pharmaceutiques suffisamment de temps pour se préparer.
Mise en œuvre des directives médicaments falsifiés – comment les emballeurs et les professionnels pharmaceutiques y arrivent-ils?
L’introduction des directives nationales et internationales sur les médicaments falsifiés pose de sérieux problèmes aux fabricants pharmaceutiques et prestataires d'emballage., tant au niveau technique que du côté des mentalités dans les entreprises. Wipotec peut vous aider à surmonter ces obstacles avec des solutions sur mesure et de nombreuses informations. L'obligation de marquer non seulement chaque lot, mais chaque emballage individuel rend souvent nécessaires des transformations de la ligne de production et de nouveaux investissements. Un certain nombre de défis attendent donc les fabricants et les emballeurs.
Une action rapide de la part des dirigeants
Une action rapide de la part des dirigeants
Une mise en conformité des règlements requiert une coopération efficace.
Dans la réalité de nombreuses entreprises nous constatons que la transformation de la ligne de production est souvent bien plus qu'un « simple » problème technique que le chef de production peut régler seul. Pour trouver la solution parfaite qui s'adapte aussi bien aux exigences des pays cibles qu'aux conditions dans sa propre entreprise il faut souvent des discussions avec plusieurs fournisseurs de solutions. Les sous-traitants doivent se mettre en relation à temps avec leurs donneurs d'ordres et leurs partenaires. Les producteurs doivent contacter leurs clients et leurs partenaires dans les meilleurs délais, car cela prend souvent du temps de trouver la solution idéale. Le défi consiste à reconnaître la priorité absolue s’agissant de ces problèmes et de dégager suffisamment de temps afin de les régler. Plusieurs tâches doivent être accomplies simultanément – il ne s'agit pas seulement de solutions variables pour le codage et le marquage des emballages et des lots, mais aussi du traitement des données et de leur transmission aux bases de données nationales.
Les solutions de Wipotec offrent ici un avantage décisif : Les interfaces libres de nos machines permettent la compatibilité avec des solutions logicielles de plusieurs prestataires de niveau 3.
Apprenez-en davantage sur les avantages des interfaces XML libres!
Vous ne pouvez plus attendre ? TQS Fast Track est la solution plug-and-play rapide pour une sérialisation entièrement automatisée en 6 semaines!
La qualité d'impression et de la gestion des données
Les exigences vis-à-vis de la qualité d'impression et de la gestion des données demandent des investissements
Il ne faut pas non plus sous-estimer la charge d'investissement pour trouver, acheter et intégrer les solutions adaptées. Imprimer des codes et textes durables d'une grande résolution, toujours lisibles par machine, sur les emballages n'est pas une mince affaire. Les cadences élevées rendent nécessaire l'utilisation de technologies de transport des produits appropriées pour éviter de maculer l'impression. L'impression doit également résister à la lumière et à l'abrasion sur différents supports pour garantir la lisibilité des marquages pendant toute la durée de vie du produit. Seule une grande correspondance permet d'éviter le rejet des produits par les systèmes de reconnaissance d'image. Des systèmes d'impression et de transport des produits adaptés sont notamment inévitables pour les petits codes de densité élevée, pour assurer la qualité de marquage nécessaire avec une vitesse d'impression élevée.
Pour assurer la conformité avec les directives médicaments falsifiés, les fabricants pharmaceutiques et les prestataires d'emballage ne devront pas faire des économies de bouts de chandelles. Le RSI : pérenniser la compétitivité sur le marché.
Flexibilité
Un marché international demande une grande flexibilité
Les fabricants fournissant plusieurs régions depuis une même usine doivent apporter la flexibilité nécessaire pour différents formats et mises en page d'impression. Cela signifie également que leur ligne d'emballage et les imprimantes doivent pouvoir être réglées rapidement et sans erreur à la directive médicaments falsifiés respective. Pour cela, les fabricants doivent créer le jeu de données respectif pour chaque produit individuel, puis le charger dans le système de base de données national ou international correspondant. Les interfaces faciles à utiliser des solutions de Wipotec avec la fonction logicielle ConfigureFast permettent un réglage rapide et sans erreur des codes spécifiques aux pays sans retards dans le fonctionnement de l'entreprise. Ce logiciel flexible permet un changement de code sans complications. Le LineManager intégré enregistre d'abord toutes les données de production dans la mémoire intermédiaire locale, puis il les transmet au système de niveau 3 raccordé. La mémoire temporaire protège les données contre une perte en cas de panne de courant ou d'autres aléas.
Des solutions compactes pour les espaces réduits : Track & Trace sur la Fast Track
Dans les lignes de production et d'emballage des fabricants pharmaceutiques et sous-traitants d'emballage des emplacements libres sont une denrée rare. Les machines très compactes de Wipotec facilitent l'intégration de fonctions importantes dans les lignes existantes avec un encombrement minimum. Le meilleur : Avec nos solutions Fast Track, votre sérialisation est prête en seulement 6 semaines.
La TQS-SP permet la sérialisation et l'étiquetage inviolable (tamper evident) d'emballages individuels de médicaments en un minimum de place. La TQS-HC-A avec Tamper Evident effectue trois tâches sur une longueur de 1800 mm de manière entièrement automatique: Triage pondéral, sérialisation et étiquetage.
It’s worth seeing the international falsification directives as an opportunity to optimise your business performance and contribute to patient protection.
- Full compliance with the FMD will guarantee your continued marketability.
- You’ll be one step ahead of your competitors due to your flexibility with our solutions.
- The traceability of products required by the falsification directives will provide you with valuable Track & Trace data on the efficiency of your supply chain and sales – allowing you to control and optimise your operations.
Find the right solution for your application now!
Successful solutions for the pharmaceutical industry: Find out more about customer projects with Wipotec.



![[Bitte in "Français" übersetzen:] TQS-CP for semi-automatic aggregation of drugs [Bitte in "Français" übersetzen:] TQS-CP drug aggregation](/fileadmin/wipotec-ocs/en/applications/serialisation-pharma/Falsified-medicines-directives/tqs-cp-aggregation-drugs.jpg)


![[Bitte in "Français" übersetzen:] Product identification number PPN [Bitte in "Français" übersetzen:] Product identification number PPN](/fileadmin/wipotec-ocs/en/applications/serialisation-pharma/Falsified-medicines-directives/pharmaceutical-product-identification-number-ppn.jpg)


![[Bitte in "Français" übersetzen:] TQS-SP: User-friendly serialisation in the smallest of spaces [Bitte in "Français" übersetzen:] TQS-SP: User-friendly serialisation](/fileadmin/wipotec-ocs/en/applications/serialisation-pharma/Falsified-medicines-directives/tqs-sp-user-friendly-serialisation.jpg)
![[Bitte in "Français" übersetzen:] TQS-HC-A: Serialisation, weight inspection and tamper-evident [Bitte in "Français" übersetzen:] TQS-HC-A: Serialisation, weight inspection, tamper-evident](/fileadmin/wipotec-ocs/en/applications/serialisation-pharma/Falsified-medicines-directives/tqs-hc-a-tamper-evident.jpg)